
Lägg till som läxa
Lägg till som stjärnmärkt
Frågor hjälpmarkerade!
Alla markeringar försvinner.
KURSER /
Fysik 1
/ Kärnfysik
Introduktion till Atomfysik
I slutet av 1800-talet kunde naturvetenskapen förklara mycket men en sak som man inte förstod de bakomliggande orsakerna till var fenomenet radioaktivitet. Anledningen till detta var att man hade en inkorrekt förståelse av hur atomer var uppbyggda.
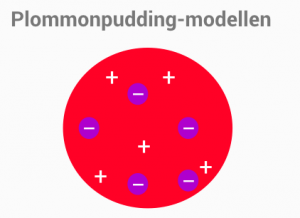
Under 1890-talet hade fysikern Joseph Thomson lagt fram sin s.k. plommon-puddings modell för atomen.
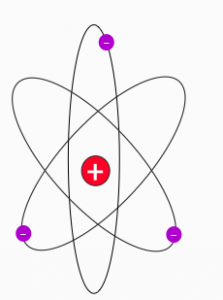
I denna modellen så tänkte man på en atom som en stor positivt laddad smet som på vissa ställen innehöll negativa laddningar. Men det dröjde inte länge förens fysikern Ernst Rutherford konstaterade att något inte stämmer med modellen. Detta gav upphov till ett kullkastande av den dåvarande modellen till fördel för en ny modell, den s.k. planetmodellen. I denna modellen består atomen av en positivt laddad kärna som omges av elektroner som kretsar omkring kärnan.
Idag så vet vi att planetmodellen inte heller är hela sanningen men i alla fall på rätt spår. Dagens modeller av atomen beskriver precis som Rutherford atomen utifrån en kärna och elektroner. Atomkärnan består av två olika typer av partiklar som kallas för neutroner och protoner.
Neutronerna som är de gröna i bilden till höger har ingen elektronisk laddning. Medan protonerna som är de röda i bilden har en positiv elektronisk laddning. En elektron är negativt laddad och laddningen är precis lika stor som protonens positiva laddning.
En atom som har lika många elektroner som protoner är därför elektrisk neutral.
Elektronernas natur är inte riktigt så enkel som klassiska partiklar som kretsar kring atomkärnan. Istället betraktar man idag elektronerna som ett moln som kan omge atomkärnan på olika bestämda sätt.
De olika sätten som en elektron kan omge atomkärnan på kallas för olika tillstånd. Vilket tillstånd som en elektron befinner sig i beror b.la. på hur mycket energi den har. En och samma atom kan därför ha olika mycket energi beroende på vilka tillstånd som dess elektroner befinner sig i. En elektron som inte befinner sig i sitt lägsta energitillstånd sägs vara exciterad.
Kommentarer
██████████████████████████
████████████████████████████████████████████████████
e-uppgifter (4)
-
1. Premium
Den atommodell som var gällande innan planetmodellen kallades för:
Bedömningsanvisningar/Manuell rättningRätta själv Klicka i rutorna och bedöm ditt svar.-
-
Rättad
-
+1
-
Rättad
Rättar... -
2. Premium
En atom vars elektron inte befinner sig i sitt lägsta energitillstånd sägs vara:
Bedömningsanvisningar/Manuell rättningRätta själv Klicka i rutorna och bedöm ditt svar.-
-
Rättad
-
+1
-
Rättad
Rättar... -
3. Premium
En elektrons laddning har (bortsett från teckenskillnaden):
Bedömningsanvisningar/Manuell rättningRätta själv Klicka i rutorna och bedöm ditt svar.-
-
Rättad
-
+1
-
Rättad
Rättar... -
4. Premium
Fysikern som lade fram planetmodellen för atomen var:
Bedömningsanvisningar/Manuell rättningRätta själv Klicka i rutorna och bedöm ditt svar.-
-
Rättad
-
+1
-
Rättad
Rättar...

Endast Premium-användare kan kommentera.